Catalysis 固氮酶新机制 氮恢复催化新发现!Nature (catalyze)
本文目录导航:
氮恢复催化新发现!Nature Catalysis:固氮酶新机制
第一作者:Chi Chung Lee
通信作者:Yilin Hu,Markus W. Ribbe
通信单位:加州大学欧文分校
论文DOI:
全文速览
钼固氮酶在惯例环境下催化恢复 N2 到 NH3 出当初 M 团簇处。
该团簇是一种复杂的辅佐因子,蕴含两个由间隙碳化物衔接的金属硫局部立方烷和三个带硫。
最近的一项晶体学钻研标明,N2 的联合是经过 M 簇的带硫在转换时的位移来成功的。
但是,在催化环节中 N2 联合和带硫移动的间接证据依然没有发现。
该钻研上班标明 N2经过电子和硫的消耗被捕捉在 M 簇上,并且 N2-捕捉形态在生成 NH3 方面具备催化才干。
此外,本文证实只要当亚硫酸盐与恢复剂一同提供时才会发消费物监禁,亚硫酸盐作为硫化物拔出到带硫置换的位置,并且在催化环节中存在带硫的灵活进出。
总之,这些结果确立了辅因子带硫的移举措为固氮酶反响的关键。
背景引见
固氮酶是一种复杂的金属酶,与农学、环境和动力等畛域有着亲密的相关。作为世界氮循环中的一个关键步骤,固氮酶在催化大气 N2 转化为动物可应用 NH3 方面的作用广为人知,固氮酶还可以在模拟环境反响中将 CO 和 CO2 恢复为碳氢化合物(例如,CH4、C2H6、C3H8),用于消费碳燃料。除了 N2和 CO,固氮酶还能够恢复多种替代底物,包括 C2H2, CN , N3和 H+,进一步说明了这种关键金属酶的催化多配置性。传统钼 (Mo) 固氮酶的催化是经过一个双组分系统成功的,该系统应用恢复酶组分将电子传递给催化组分以启动底物恢复。恢复酶成分,称为铁 (Fe) 蛋白,是一种同源二聚体,蕴含一个亚基桥接 [Fe4S4]簇和每个亚基内的 ATP 联合位点;被称为催化成分的钼铁(MoFe) 蛋白是一种α2β2-异四聚体,其在每个 α/β-亚基界面含有一个 P-簇([Fe8S7]),以及在每个 α-亚基内含有一个 M-簇 (或 FeMoco; [(-homocitrate)MoFe7S9C)。在底物转换环节中,钼固氮酶的两种成分蛋白相互构成配置复合物,使 ATP 依赖的电子从 Fe 蛋白的 [Fe4S4] 簇经过 P 簇转移到 M 簇。MoFe 蛋白,一旦积攒了足够数量的电子,就会出现底物恢复。
固氮酶的配置关键性和与生俱来的复杂性,激起了几代钻研人员对这种酶促 N2 恢复机制启动钻研;Lowe-Thorneley 模型是迄今为止最出名的动力学形容,用于解释质子的蛋白内传递和电子到 M 簇以启动底物联合、活化和恢复。
另一方面,由于这些联合物种的瞬态个性,钻研人员已证实固氮酶的底物或两边联合形态表征极具应战性。
在这方面的钻研中,冷冻淬火光谱技术与钼固氮酶活性位点基因润色相联合,已被用于表征这种酶的某些形态,这些形态或者与催化相关。
但是,取得 Mo-固氮酶配体联合形态分子形容的一个十分关键步骤来自于 MoFe 蛋白的 CO 联合方式的高分辨率晶体结构,它提醒了 μ2-CO 配体桥接在 M 簇的 Fe2 和 Fe6 之间,替代了带状硫 (S2B)。
这一结果令人兴奋,由于它指出了一种机制,触及经过取代辅佐因子的带硫发生存性 Fe 物质。
更幽默的是,在 S2B 位点启动的后续晶体脉冲追踪钻研标明辅佐因子的整个带区域或者介入催化。
图文解析
图1. N2 联合的 Av1* 的GC-MS 和频率选用性 NMR 剖析。
a、b,发生的C2H4 的 GC 洗脱曲线 (a) 和 GC-MS碎裂形式 (b);条件区分为在 D2/C2H2下的 Av1(灰色)、N2/D2/C2H2下的 Av1(蓝色)和 D2/C2H2下的 Av1*(棕色),基于 H2O 的反响。
c,在 Av2、MgATP 和连二亚硫酸盐存在下,在 Ar 下转换时,由 Av1(实心蓝色)、14N2 制备的 Av1*(实心白色)和 15N2(实心棕色)制备的 Av1* 生成 NH4+ 的频率选用性 1H NMR 光谱。
图 2. 各种 Av1 蛋白种类的 EPR 和 GC-MS 剖析。
a-j,垂直形式(a-e) 敌对行形式 (f-j) 的 EPR 光谱,用于测试静息态 Av1 (a,f),N2 联合的 Av1* (b,g),连二亚硫酸盐从新激活的 Av1* (TOD) (c,h)、Eu(II)-EGTA/亚硫酸盐再活化 Av1*(TOS) (d,i) 和 Eu(II)-EGTA/亚硒酸盐再活化 Av1*(TOSe) (e,j)。
k-o,对 Av1 (k)、Av1*(l)、Av1*(TOD) (m)、Av1*(TOS) (n)和 Av1*(TOSe) (o) 酸淬灭后监禁的 15N2 启动 GC-MS 剖析。
图 3. 底物转换对亚硫酸盐物种的需要。
a,在含有 Av2、MgATP 和Eu(II)-EGTA 的体外活性测定中,在不存在 (-S) 或存在各种硫源(+S2-,+SO42和 +SO32 )或亚硒酸盐 (+SeO32-) 的状况下,Av1* 的活性。
b,在含有 Av2、MgATP 和 Eu(II)-EGTA 的体外测定中,Av1* 的 C2H2 恢复生性与亚硫酸盐 (SO32-)或亚硒酸盐 (SeO32-) 浓度的滴定相关。
c,经常使用 2mM SO32-(实心绿色固体)或 NFE(空心圆圈)作为硫源,在 C2H2 恢复中,Av1* 活性与期间的相关。
图 4. Av1*(TOS) 的晶体学剖析。
Av1*(TOS) 的链-A/B (P-团簇(A/B)) (a) 和 链-C/D(P-团簇(C/D)) (b) 界面处的P-团簇结构。
原子色彩编码:Fe,橙色;S,黄色;O,白色;N,蓝色。
c-f,链-A(M-簇(A))(c,e)和链-C(M-簇(C))(d,f)中,M-团簇的结构。
c,d,侧视图;e,f,沿M-团簇(A) (c,e) 和 M-团簇(C)(d,f) 的 Fe1-C-Mo 轴的视图。
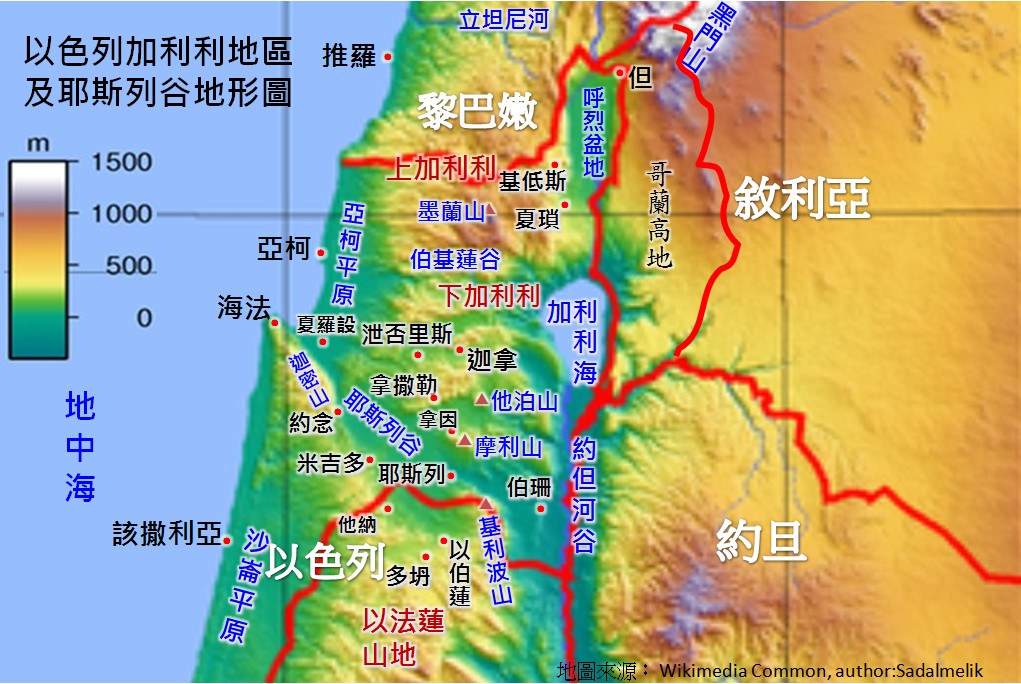
图 5. 带状硫与催化相关的移动。
a,各种 Av1 蛋白或蛋白链中单个硫或硫基团的相对电子密度。
b,c, GC-MS 剖析 Av1*(TOS) (b) 及其分别的 M-簇 (c) 中酸不稳固、簇联合的 34S2- 离子的监禁。
d, ICP-OES 测定从不雷同品提取的 M 簇中的 Se/Mo 比。
图 6. Av1*(TOSe) 的XAS/EXAFS 剖析。
a-g,对 Av1*(TOS) 在适量 SeO32中转换10min(指定为 Av1*(TOSe),彩色),Av1* (TOSe) 在适量 SO32中转换 5min(指定为 Av1*(TOSe)5min,蓝色)和 Av1*(TOSe) 在适量 SO32转换 60min(指定Av1*(TOSe) 60min,白色),取得的Fe (a-d) 和 Se K-edge XAS 剖析 (e-g)。
图 7. SO32-的配位和恢复。
a-c,由 SO32- 或 NH3配位的 M 簇的 DFT 提升模型。
d,两种SO32-配位状况下的反响能,假定耦合的 e-/H+ 转移出当初初始配位步骤之后。
e,在两种SO32-配位状况下,硫掺入的累积反响能。
总结与展望
基于上述结果,本文联合经常使用生化、剖析、光谱和结构方法来证实 N2 在电子和硫耗尽条件下被捕捉在 M 簇上,并且这种 N2 捕捉形态与催化相关,能够发生 NH3。
此外,钻研标明产物监禁仅在亚硫酸盐和恢复剂存在的状况下出现,亚硫酸盐作为硫化物拔出到带硫置换的位置,并且在催化环节中存在带硫的灵活流动。
这些证据独特指出带硫的移动是固氮酶机制的一个新的关键起因。
bi3++seo32-化学方程式
2Bi3+ + 3SeO32- = Bi2(SeO3)3↓
seo3和seo32哪个键角大
SEO3的键角大于SEO32的键角。
键角是形容分子边疆子间夹角大小的物理量,关于便捷的AB2型分子,如二氧化碳(CO2)或三氧化硫(SO3),键角是确定分子形态的关键起因。
在SEO3和SEO32这两种分子中,硒(Se)原子与氧(O)原子之间经过共价键衔接。
由于硒的电负性较小,与氧原子之间的电子云密度会倾向于氧原子,造成硒原子周围的电子云密度较低,键协作用相对较弱。
关于SEO3分子,由于它是一个平面三角形结构,每个氧原子都与硒原子构成一个双键,三个双键之间的排挤力相对平衡,因此键角较大,凑近120°。
而在SEO32分子中,只管硒原子与氧原子之间也是双键衔接,但由于多了一个孤对电子对,这个孤对电子对会占据必定的空间,并对周围的键合电子对发生排挤作用,造成键角被紧缩,小于120°。
另外,从分子构型稳固性方面思考,SEO3的平面三角形结构在能量上更为稳固,由于这种结构使得分子的电荷散布更为平均,降落了分子外部的电荷密度差异,从而缩小了分子间的相互作用能。
而SEO32由于存在孤对电子对,其分子构型稳固性相对较差,键角也因此遭到影响。
综上所述,由于SEO3分子具备更为稳固的平面三角形结构,其键角大于SEO32分子的键角。
这一论断基于分子构型稳固性和电子云散布的剖析,反映了分子外部原子间相互作用对键角大小的影响。




文章评论